|
|
| |
|
|
| |
| |

 |

■研究代表者プロフィール
和田芳直 Yoshinao
Wada (MD.,PhD)
大阪大学大学院医学系研究科分子病態医学専攻(連携)・教授/大阪府立母子保健総合医療センター研究所・所長
1975年 大阪大学医学部卒業、市立病院内科医などを経て、79年 世界で初めて質量変化によってタンパク質構造変異を解析する方法論を発表し、構造決定に成功、81年 大阪府立母子保健総合医療センター、91年 同研究所代謝部長、98年より現職。専門は質量分析学、母子医学。主な著書にEncyclopedia
of Mass Spectrometry (Elsevier)など。日本医用マススペクトル学会賞、国際質量分析協会アジア代表
 |
研究代表者:
|
和田芳直(分子病態医学(連携)・招へい教授/大阪府立母子保健総合医療センター研究所・所長) |
| |
|
| 研究分担者: |
渋川幸直(大阪府立母子保健総合医療センター・研究員) |
| 研究協力者: |
田尻道子(科学技術振興機構・技術員)
岡本伸彦(大阪府立母子保健総合医療センター・企画調査部参事) |
|


質量分析法はプロテオームになくてはならない基盤技術であるが、また、開発の余地が大きく残された技術でもある。われわれのグループは、イオン化に始まる基本的な質量分析法の開発・改良から、生命科学に必要な解析技法をつくり、それらを用いて実際に生命現象の解明や疾患解析を行うことを課題としている。
最新の成果としては、マトリックスを使用しないレーザーイオン化のための新しい試料ターゲットを開発し、また、糖タンパク質のプロテオーム、すなわちグリコプロテオームのための基本手法として、糖ペプチドの新しい迅速解析法を開発した。この新しい技術によれば、物性の異なる糖鎖とペプチドからなる複合分子を分離・分解することなく、その糖鎖構造とペプチドのアミノ酸配列を解析することができる。実際、極めて大きな糖タンパク質における部位特異的な糖鎖構造解析についても何ら問題なく実施できることから、その能力が実証され、ようやく、糖鎖を介した細胞間情報伝達機構を、構造/機能関係において解明することができる状況をつくりだすことができた。
これらの技術を武器に、新しい疾患群として注目されようとしている糖鎖合成不全症Congenital Disorders of Glycosylation(CDG)の分子診断プログラムを開始した。例えば、N-結合型糖鎖の合成に関わる遺伝子だけでも約80あり、その他、O-結合型も含めると、糖鎖付加に関わるかあるいは影響を与える遺伝子の数は500程度になるとされている。すなわち、それだけの数の疾患があり得るわけである。特定のタンパクでなく、あらゆる糖タンパク質の量と質に影響を及ぼし得るが故に、障害が多臓器、他器官に及び、症状が極めて多彩となって臨床診断が極めて困難なCDGの実態をやがて明らかにできるものと期待している。
このように、分析法のハードとソフト、そして、臨床の場をまでカバーするという大きな研究の幅をもった研究を進めている。
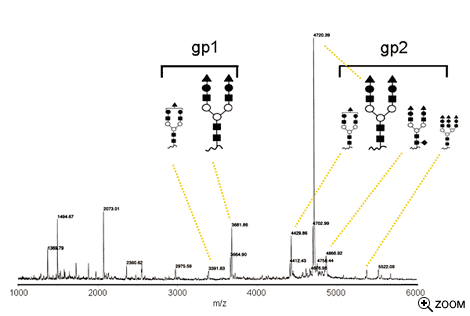
新しい解析技術による糖タンパク質の部位特異的糖鎖構造解析。ナノグラムのタンパク質を開始試料として、部位特異的な糖鎖構造のミクロ不均一性を解析した例。


 |
| 1) |
Wada Y, Azadi P, Costello CE, Dell A, Dwek RA, Geyer H, Geyer R, Kakehi K, Karlsson NG, Kato K, Kawasaki N, Khoo KH, Kim S, Kondo A, Lattova E, Mechref Y, Miyoshi E, Nakamura K, Narimatsu H, Novotny MV, Packer NH, Perreault H, Peter-Katalinic J, Pohlentz G, Reinhold VN, Rudd PM, Suzuki A, and Taniguchi N. “Comparison of the Methods for Profiling Glycoprotein Glycans: HUPO HGPI (Human Proteome Organisation Human Disease Glycomics/Proteome Initiative) Multi-institutional Study.” Glycobiology, 17, 411-422, 2007. |
| 2) |
Wada Y. (review) “Mass spectrometry for congenital disorders of glycosylation, CDG.” J Chromatogr B Analyt Technol Biomed Life Sci., 838, 3-8, 2006. |
| 3) |
Tajiri M, Yoshida S, and Wada Y. “Differential analysis of site-specific glycans on plasma and cellular fibronectins: Application of a hydrophilic affinity method for glycopeptide enrichment.” Glycobiology, 15, 1332-1340, 2005. |
| 4) |
Okuno S, Arakawa R, Okamoto K, Matsui Y, Seki S, Kozawa T, Tagawa S, and Wada Y. “Requirements for laser-induced desorption/ionization on submicrometer structures.” Anal. Chem., 77, 5364-5369, 2005. |
| 5) |
Wada Y, Tajiri M, and Yoshida S. “Hydrophilic affinity isolation and MALDI multiple-stage tandem mass spectrometry of glycopeptides for glycoproteomics.” Anal. Chem., 76, 6560-6565, 2004. |
|
|
|
|
|
| PAGE TOP |
Copyright 2003 Osaka University. All Right Reserved.
Integrated functional analyses of disease-associated sugar chains and proteins, Osaka University

|
|
|
|
|